Transmisión, síntomas y diagnóstico de Mycoplasma bovis en el ganado

Transmisión de Mycoplasma bovis
La principal vía de entrada de Mycoplasma bovis en una explotación ganadera es a través de la introducción de animales infectados. Este patógeno se elimina mediante las secreciones vaginales, respiratorias y, en particular, a través de la leche. Los terneros pueden infectarse al nacer, ya sea por contacto con la madre u otras vacas adultas, siendo la leche una de las vías más comunes de transmisión.
Una sola vaca infectada que elimine micoplasmas en la leche puede infectar un gran número de terneros durante un largo periodo de tiempo. Además, si los cubos de distribución de la leche o las tetinas se intercambian de un corral a otro y no se limpian y desinfectan adecuadamente entre tomas, la diseminación se produce rápidamente.
Otra vía importante es a través de aerosoles y por el contacto estrecho y repetido de animales no infectados con los terneros infectados que eliminan M. bovis vía respiratoria.
Por último, la transmisión también se puede producir por vía indirecta a través de agua, pienso, cama… contaminados por las secreciones de terneros infectados. En este sentido, aunque M. bovis carece de pared celular, puede sobrevivir a condiciones ambientales adversas debido a su capacidad para formar biofilms. Se ha demostrado la supervivencia durante 8 meses en camas de arena en condiciones de humedad y temperatura entre 15-20ºC y durante varias semanas en materia orgánica.
La colonización del tracto respiratorio superior por M. bovis ocurre rápidamente en el caso de los terneros mamones. En un estudio en una granja con una infección endémica, el 50% de los terneros eliminaban micoplasmas a los 5 días y el 90% a las 4 semanas de edad.
En el caso de terneros de carne, varios estudios han mostrado que mientras que un pequeño porcentaje de animales están infectados a la entrada al cebadero, prácticamente la totalidad de los animales están infectados a las 2 semanas. En un estudio realizado en Francia, solo un 2% de los terneros eran seropositivos a la entrada, pero entre uno y dos meses después el 90% de los animales habían seroconvertido.
Síntomas de infección por Mycoplasma bovis
La infección por M. bovis puede presentarse de diversas formas, incluyendo neumonía, otitis media, artritis y, en algunos casos, una combinación de estos síntomas. El comienzo de los síntomas en los animales infectados ocurre normalmente entre las 2-6 semanas de edad, aunque hay casos en que se han observado a los 4 días.
La sintomatología respiratoria no se diferencia de la producida por otros patógenos: fiebre, taquipnea, disnea, pérdida del apetito, descarga nasal y tos. Esta sintomatología tiende a hacerse crónica, debilitante y con poca respuesta a la terapia. Por ello, en estos animales se observa una disnea severa y emaciación asociada a una pobre ganancia de peso.
En los últimos años en Norteamérica se ha visto un aumento de los casos de otitis media asociados a M. bovis, sobre todo en terneras de leche. La diseminación desde el tracto respiratorio al oído medio ocurriría principalmente por colonización de la orofaringe y difusión en la bulla timpánica vía trompa de Eustaquio, aunque también se podría producir vía hematógena, o por extensión de una infección del oído externo.
Los signos clínicos que se observan en estos casos serían la pérdida de apetito, fiebre, depresión, dolor que se manifiesta por que el animal agita la cabeza y se rasca o frota las orejas, orejas caídas y otros síntomas asociados a la parálisis del nervio facial. En algunas ocasiones se rompe la membrana timpánica y se observa una descarga purulenta en el canal auditivo.
La artritis puede observarse en animales de todas las edades y generalmente son esporádicos y ocurren en animales afectados de neumonía o mamitis. En cebaderos se han descrito brotes del denominado síndrome de neumonía crónica y artritis. M. bovis alcanza las articulaciones vía hematógena y los síntomas son los típicos de una artritis séptica: articulaciones dolorosas e hinchadas, cojera más o menos marcada y fiebre en la fase aguda del proceso. Un hecho frecuente es la pobre o nula respuesta al tratamiento en estos casos.

Finalmente, M. bovis se ha aislado a partir de casos de mamitis en vacas de cualquier edad y lactación, incluyendo novillas y vacas secas. También se ha descrito en casos de queratoconjuntivtis, meningitis, abscesos y alteraciones reproductivas.
Lesiones provocadas por Mycoplasma bovis
En principio, la lesión típica producida por M. bovis es una consolidación pulmonar craneoventral acompañada frecuentemente por una bronquiolitis supurativa y engrosamiento de septos interlobulares. Sin embargo, más recientemente la lesión que se observa con mayor frecuencia es bronconeumonía crónica caseonecrótica.
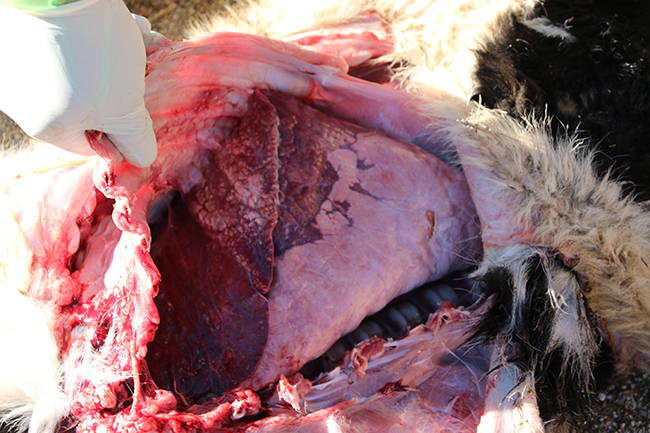
Así, se considera prácticamente patognomónica la presencia de múltiples focos de necrosis caseosa de aspecto secos en el tejido pulmonar y que se observan mejor en la superficie interna que queda expuesta al cortar el pulmón.
Sin embargo, a pesar de la sintomatología y de las lesiones pulmonares tan características, es necesario el diagnóstico laboratorial para confirmar la infección.
Diagnóstico de Mycopasma bovis
Las muestras para el diagnóstico en animales vivos serían hisopos nasales profundos incluidos en medio de transporte adecuado y lavados broncoalveolares en casos de neumonía; líquido sinovial en casos de artritis y leche de tanque y/o de animales afectados en los casos de mamitis. En caso de animales muertos, zonas de pulmón que incluyan parte sana y parte afectada, lavado pulmonar, hisopos de tráquea en medio de transporte y fluido articular. Las técnicas de diagnóstico más utilizadas son el cultivo, la detección por técnicas de PCR y en caso de tejidos, las técnicas inmunohistoquímicas.
En todos los casos, las muestras anteriores deberán acompañarse del envío de suero de animales afectados y animales en contacto con ellos.
La detección de anticuerpos frente a Mycoplasma bovis por ELISA es el método diagnóstico más fiable, ya que los niveles de anticuerpos se mantienen a niveles detectables durante meses. Esto es sobre todo cierto en los casos en que se ha iniciado el tratamiento y se compara con el aislamiento del micoplasma como prueba diagnóstica.
Si quieres ampliar información sobre Mycoplasma bovis, consulta otros artículos en nuestro blog.
Bibliografía
1- Abell KM, Theurer ME, Larson RL, White BJ, Apley M. 2017. A mixed treatment comparison meta-analysis of metaphylaxis treatments for bovine respiratory disease in beef cattle. J Anim Sci; 95(2): 626-635.
2- Apley M. 2006. Bovine respiratory disease:pathogenesis, clinical signs, and treatment in lightweight calves. Vet Clin North Am Food Anim Pract; 22: 399-411.
3- Bartram DJ, Moyaert H, Vanimisetti BH, Ramage CP, Reddick D, Stegemann MR. Comparative efficacy of tulathromycin and tildipirosin for the treatment of experimental Mycoplasma bovis infection in calves. Vet. Med. Sci; 2: 170-178.
4- Bürki S, Frey J, Pilo P. 2015. Virulence, persistence and dissemination of Mycoplasma bovis. Vet Microbiol; 179 (1-2):15-22.
5- Caswell JL, Archambault M. 2007. Mycoplasma bovis pneumonia in cattle. Anim Health Res Rev; 8(2): 161-86.
6- Caswell JL, Bateman KG, Cai HY, Castillo-Alcala F. 2010. Mycoplasma bovis in respiratory disease of feedlot cattle. Vet Clin North Am Food Anim Pract. ; 26(2): 365-79.
7- Gautier-Bouchardon AV, Ferre S, Le Grand D, Paoli A, Gay E, Poumarat F. 2014. Overall decrease in the susceptibility of Mycoplasma bovis to antimicrobials over the past 30 years in France. PLoS ONE 9:e87672. doi: 10.1371/journal.pone.0087672.
8- Gershwin LJ, Van Eenennaam AL, Anderson ML, McEligot HA, Shao MX, Toaff-Rosenstein R, Taylor JF, Neibergs HL, Womack J; Bovine Respiratory Disease Complex Coordinated Agricultural Project Research Team. 2015. PLoS One; 10(11): e0142479. doi: 10.1371/journal.pone.0142479.
9- Godinho KS. 2008. Susceptibility testing of tulathromycin: interpretative breakpoints and susceptibility of field isolates. Vet. Microbiol. 129, 426–432.
10- Godinho KS, Rae A., Windsor GD, Tilt N, Rowan TG, Sunderland SJ. 2005. Efficacy of tulathromycin in the treatment of bovine respiratory disease associated with induced Mycoplasma bovis infections in young dairy calves. Vet. Ther. 6, 96–112.
11- Goto S, Konnai S, Okagawa T, Nishimori A, Maekawa N, Gondaira S, Higuchi H, Koiwa M, Tajima M, Kohara J, Ogasawara S, Kato Y, Suzuki Y, Murata S, Ohashi K. 2017. Increase of cells expressing PD-1 and PD-L1 and enhancement of IFN-γ production via PD-1/PD-L1 blockade in bovine mycoplasmosis. Immun Inflamm Dis. doi: 10.1002/iid3.173.
12- Griffin D, Chengappa MMDVM, Kuszak J, Scott D, McVey DVM. 2010. Bacterial pathogens of the bovine respiratory disease complex. Vet Clin North Am Food Anim Pract; 26(2): 381-394
13- Heins BD, Nydam DV, Woolums AR, Berghaus RD, Overton MW. 2014. Comparative efficacy of enrofloxacin and tulathromycin for treatment of preweaning respiratory disease in dairy heifers. J Dairy Sci; 97(1): 372-82.
14- Ives SE, Richeson JT. 2015. Use of antimicrobial metaphylaxis for the control of bovine respiratory disease in high-risk cattle. Vet Clin North Am Food Anim Pract; 31(3): 341-50.
15- Jimbo S, Suleman M, Maina T, Prysliak T, Mulongo M, Perez-Casal J. 2017. Effect of Mycoplasma bovis on bovine neutrophils. Vet Immunol Immunopathol; 188: 27-33.
16- Lysnyansky I, Ayling RD. 2016. Mycoplasma bovis: Mechanisms of resistance and trends in antimicrobial susceptibility. Front Microbiol.; 7: 595.
17- Maunsell FP, Donovan GA. Mycoplasma bovis Infections in young calves. 2009. Vet Clin North Am Food Anim Pract; 25(1):139-77.
18- Maunsell FP, Woolums AR, Francoz D, Rosenbusch RF, Step DL, Wilson DJ, Janzen ED. 2011. Mycoplasma bovis infections in cattle. J Vet Intern Med; 25(4): 772-83.
19- McAuliffe L, Ellis RJ, Miles K, Ayling RD, Nicholas RAJ. 2006. Biofilm formation by mycoplasma species and its role in environmental persistence and survival. Microbiology 152, 913–922.
20- Mulongo M, Prysliak T, Scruten E, Napper S, Perez-Casal J. 2014. In vitro infection of bovine monocytes with Mycoplasma bovis delays apoptosis and suppresses production of gamma interfero n and tumor necrosis factor alpha but not interleukin-10. Infect Immun; 82(1): 62-71.
21- Murray GM, O'Neill RG, More SJ, McElroy MC, Earley B, Cassidy JP. 2016. Evolving views on bovine respiratory disease: An appraisal of selected key pathogens - Part 1. Vet J; 217: 78-82.
22- Murray GM, O'Neill RG, More SJ, McElroy MC, Earley B, Cassidy JP. 2016. Evolving views on bovine respiratory disease: An appraisal of selected control measures - Part 2. Vet J; 217: 78-82.
23- Nicholas RA. 2011. Bovine mycoplasmosis: silent and deadly. Vet Rec; 168(17): 459-62.
24- Nicholas RA, Ayling RD. 2003. Mycoplasma bovis: disease, diagnosis, and control. Res. Vet. Sci. 74, 105–112.
25- Nickell JS, White BJ. 2010. Metaphylactic antimicrobial therapy for bovine respiratory disease in stocker and feedlot cattle. Vet Clin North Am Food Anim Pract; 26: 285-301.
26- O'Connor AM, Coetzee JF, da Silva N, Wang C. 2013. A mixed treatment comparison meta-analysis of antibiotic treatments for bovine respiratory disease. Prev Vet Med; 110: 77–87.
27- Simons WL, Dybvig K. 2007. How some mycoplasmas evade host immune responses. Microbe; 2(11): 537-543.
28- Stipkovits L, Ripley PH, Tenk M, Glavits R, Molnar T, Fodor L. 2005. The efficacy of valnemulin (EconorR) in the control of disease caused by experimental infection of calves with Mycoplasma bovis. Res. Vet. Sci. 78, 207–215.
29- Taylor DJ, Fulton RW, Lehenbauer TW, Step DL, Confer AW. 2010. The epidemiology of bovine respiratory disease: What is the evidence for preventive measures?. Can Vet J; 31: 1351-1359.
30- Thomas A, Mainil TA, Linden A. 2003. Mycoplasma bovis: synthèse des connaissances actuelles. Ann Med Vét; 147: 23-39.